INTRODUCTION
대장균(Escherichia coli)은 사람이나 동물의 장관 내 분포하는 정상균무리로 자연계에 널리 분포하고 있으며 대부분은 병원성이 없다. 그러나 일부 대장균은 사람에게 급성위장염을 일으키는데 이를 병원성대장균(pathogenic E. coli)이라 한다 (1). 병원성대장균은 병리학적 기전, 독성인자 및 임상양상 등에 따라 장출혈성대장균(enterohemorrhagic E. coli, EHEC), 장병원성대장균(enteropathogenic E. coli, EPEC), 장독소성대장균(enterotoxigenic E. coli, ETEC), 장응집성대장균(enteroaggregative E. coli, EAEC), 장침입성대장균(enteroinvasive E. coli, EIEC) 등으로 분류하고 있다 (2).
장출혈성대장균은 설사와 출혈성 장염을 일으키는데, 임상적으로 환자의 5~10%는 사구체 손상으로 인한 용혈요독증후군(hemolytic uremic syndrome; HUS)의 심한 합병증에 이를 수 있다. 장출혈성대장균은 verotoxin (shiga-toxin)을 생성하므로 베로독소 생성 대장균(verotoxin-producing E. coli, VTEC) 또는 시가독소 생성 대장균(shiga toxin-producing E. coli, STEC)으로 명명되기도 한다 (3). 베로독소를 생산하는 장출혈성대장균에는 vt1과 vt2 둘 중 하나만 생산하는 것과 두 개를 동시에 생산하는 것으로 분류할 수 있는데, 어느 종류의 베로독소를 생산하는지에 따라 병원성의 정도에 차이가 있다 (4).
장병원성대장균은 개발도상국에서 발생하는 신생아 설사의 중요한 원인균으로 attaching and effacing (A/E) 병변을 초래하여 장관 상피세포에 부착하고 미세융모를 파괴한다고 알려져 있다 (5, 6). 이러한 병원성 기전에는 미세융모를 소멸시키는 intimin (eaeA)과 plasmid에 위치한 부착인자인 bfp (bundle forming pili)가 관여하는데 부착인자를 가지면 전형적 장병원성대장균(typical EPEC)이라 하고, 부착인자를 가지지 않으면 비전형적 장병원성대장균(atypical EPEC)이라고 정의하고 있다 (7).
장독소성대장균은 여행자설사의 가장 흔한 원인균으로 알려져 있었으나, 최근 오염된 식품이나 물에 의한 집단식중독에서 많이 검출되고 있다 (8, 9). ETEC는 두 개의 장독소를 생산하며, 60℃에서 10분간 가열했을 때 활성을 잃는 이열성 독소(heat labile toxin; LT)와 100℃에서 30분간 가열해도 활성을 나타내는 내열성 독소(heat stable toxin; ST)를 하나 또는 두 개 모두 생성한다. 이 장독소가 소장 상피에서 나트륨 이온과 염소 이온의 흡수를 방해하고 수분 분비를 촉진하여 복통과 물설사(watery diarrhea)를 야기한다 (10).
장응집성대장균은 소아와 성인에게 만성적인 설사를 유발하며, 개발도상국에서 소아의 급성설사증을 일으키는 주요 원인균으로 알려져 있다 (11). EAEC는 배양세포에 특징적인 응집모양을 나타내며 응집성 부착 섬모의 발현에 관여하는 aggR 유전자를 보유하고 있다 (12).
장침투성대장균은 장 상피세포에 침투하고 증식하여 세포를 파괴하는데, 주로 위생시설이 열악한 곳에서 많이 발생하며, 소아의 대장 점막 상피세포 내로 침범하여 증식하고 점막을 괴사시켜 궤양을 형성한다. EIEC는 유전학적으로 시겔라 종(Shigella spp.)과 밀접하게 연관되어 있으며, 발열, 복부경련, 혈액성 및 점액성 설사 등을 일으킨다 (13, 14, 15).
병원성대장균은 주로 오염된 식품이나 물의 섭취, 동물과 환자와의 접촉 등에 의해 감염되는데, 학교와 회사의 집단 급식의 보편화, 육류 소비와 외식문화의 증가 등 식습관의 변화와 더불어 고령화로 인한 감염 취약 계층의 증가, 해외여행 및 국제교류로 인한 해외 유입 가능성 등으로 인해 병원성대장균의 오염 위험이 더욱 커지고 있다. 국내 식품의약품안전처 자료에 따르면 최근 10년간 세균성 식중독 원인균 1위는 병원성대장균이었으며 2023년도에 발생 건수 44건, 환자 2,009명으로 전체 식중독 환자의 23.7%를 차지하였다 (16). 이렇듯 병원성대장균에 의한 집단발병 사례가 증가하면서 집단식중독의 원인균으로 병원성대장균의 특성 연구를 통한 관리 대책 마련이 필요해졌다. 특히 병원성대장균을 비롯한 세균에 의한 감염성 질환은 항생제를 이용하여 치료하고 있지만, 우리나라의 항생제 사용량은 인체 및 비인체 분야 모두 OECD 평균보다 매우 높다. 따라서 세균들이 다양한 경로를 통해 항생제와 접하게 되는 기회가 많아지면서 여러 종류의 내성균이 출현하여 감염의 치료가 어려워지고 있는 실정이다 (17, 18).
본 연구는 2020년부터 2022년까지 경기도에서 발생한 집단식중독 환자에서 분리한 병원성대장균의 발생 현황과 이들 병원성대장균의 병원성 유전자, 혈청형 분석, 항생제 감수성, 그리고 내성 유전자 등 다양한 특성을 분석하였다.
MATERIALS AND METHODS
병원성대장균의 분리 및 동정
2020년부터 2022년까지 경기도에서 발생한 집단식중독 환자로부터 분리한 병원성대장균 144주를 연구에 사용하였다. 병원성대장균 분리를 위해 MacConkey agar (Oxoid, UK) 배지에 검체를 도말한 후 37℃에서 18~24시간 배양한 다음 분홍색 집락을 선택하여 E. coli detection kit (GenetBio, Korea)를 사용하여 병원성 유전자를 확인하였다. 병원성 유전자를 가진 균주는 Tryptic soy agar (TSA, BD, USA)에 순수분리한 후 최종적으로 VITEK GN card (Biomérieux, France)를 이용하여 동정하였다.
혈청형 시험
혈청형은 O항원 슬라이드 응집반응으로 확인하였다. TSA 배지에 순수분리된 균을 0.85% NaCl 1 mL에 균질하게 부유시키고 100℃에서 1시간 가열한 후 10,000 rpm에서 3분 원심분리하였다. 상등액은 버리고 원심침사를 생리식염수 500 μL로 다시 부유시킨 것을 균 부유액으로 사용하였다. 슬라이드 글라스에 대장균 O항혈청(Joongkyeom, Korea) 1방울과 균 부유액 20 μL를 섞고 1분 이내 응집반응으로 결과를 판독하였다.
항생제 감수성 시험
TSA 배지에서 37℃, 18~24시간 배양한 병원성대장균을 취해 0.45% NaCl 3 mL에 부유시켜 MacFarland 0.6으로 조정하였다. 이 균액 145 μL를 새로운 0.45% NaCl 3 mL에 희석한 후 VITEK-2 AST-N169 card (BioMérieux, France)를 사용하여 항생제 감수성 시험을 하였다. Quality control 균주로는 E. coli ATCC 25922를 사용하였다.
항생제 내성 유전자 확인
TSA 배지에 순수분리된 균 집락을 200 μL 멸균 증류수에 부유시키고 100℃에서 10분간 끓인 다음 13,000 rpm에서 5분 원심분리 후 상등액을 PCR 주형 DNA로 사용하였다. 항생제 내성 유전자는 본 연구에 사용된 항생제 계열과 관련된 유전자를 선정한 후 프라이머를 제작하였다(Macrogen, Korea) (Table 1). PCR 반응은 AccuPower Gold Multiplex PCR PreMix Kit (Bioneer, Korea)를 사용하였으며, 각 프라이머 1 μL와 주형 DNA 5 μL를 첨가한 뒤 ProFlex 96well (Life technologies) 기기를 사용하여 수행하였다. PCR 반응 후 최종적으로 전기영동(QIAxcel, QIAGEN, Germany)을 하여 유전자별 증폭 산물의 유무를 확인하였다.
Table 1.
Primers used in this study
| Target gene | Sequence (5’ → 3’) | Amplicon size (bp) | Reference |
|---|---|---|---|
| blaTEM | ATA AAA TTC TTG AAG ACG AAA | 1,080 | (19) |
| GAC AGT TAC CAA TGC TTA ATC | |||
| blaOXA | TCA ACT TTC AAG ATC GCA | 591 | |
| GTG TGT TTA GAA TGG TGA | |||
| blaCTX-M | CGC TTT GCG ATG TGC AG | 550 | |
| ACC GCG ATA TCG TTG GT | |||
| qnrA | ATT TCT CAC GCC AGG ATT TG | 516 | |
| GAT CGG CAA AGG TTA GGT CA | |||
| qnrB | GAT CGT GAA AGC CAG AAA GG | 469 | |
| ACG ATG CCT GGT AGT TGT CC | |||
| qnrS | ACG ACA TTC GTC AAC TGC AA | 417 | |
| TAA ATT GGC ACC CTG TAG GC | |||
| tetA | GGC GGT CTT CTT CAT CAT GC | 502 | (20) |
| CGG CAG GCA GAG CAA GTA GA | |||
| tetB | CAT TAA TAG GCG CAT CGC TG | 930 | |
| TGA AGG TCA TCG ATA GCA GG | |||
| sul1 | GTG ACG GTG TTC GGC ATT CT | 779 | |
| TCC GAG AAG GTG ATT GCG CT | |||
| sul2 | CGG CAT CGT CAA CAT AAC CT | 721 | |
| TGT GCG GAT GAA GTC AGC TC |
RESULTS AND DISCUSSION
병원성대장균의 분리 경향
2020년부터 2022년까지 경기도에서 발생한 집단식중독 8건에서 분리된 병원성대장균은 총 144주로 EHEC가 44주로 가장 많이 분리되었고, EAEC는 39주, EPEC는 38주, 그리고 ETEC는 23주 분리되었다 (Table 2). 발생 지역은 안산시와 오산시에서 각각 2건, 양평군, 광주시, 안양시, 화성시에서 각각 1건이었다. 식중독은 유치원, 어린이집, 기업체에서 각각 1건 발생하였고, 나머지 5건은 학교에서 발생하여 8건 모두 집단급식소에서 발생하였다. 식품의약품안전처에 따르면 최근 5년간 전국의 병원성대장균 식중독 발생 장소는 음식점 43%, 학교급식소 28%, 유치원, 어린이집, 기업체 등 집단급식소 21% 순으로 나타나 전체 발생 중 49%가 집단급식소에서 발생하였다 (15). 단체 급식의 경우 오염 시 대규모 집단 감염으로 발생할 위험이 크므로 이에 대한 중점적인 위생관리가 요구된다.
Table 2.
Cases of food-borne outbreak by pathogenic E. coli in Gyeonggi-do, Korea
일반적으로 단일 집단감염의 경우 동일한 종류의 병원성대장균이 분리되지만, 양평군에서 발생한 case 2와 오산시에서 발생한 case 3의 경우 여러 종류의 병원성대장균이 분리되었다. Case 2는 환자 검체에서 병원성대장균이 분리되었지만, 섭취 식품에서는 확인된 병원체가 없었고 조리용수에서 대장균군, 분원성 대장균군이 검출되어 분변오염이 있었음을 간접적으로 확인하였다. Case 3도 환자 검체에서 병원성대장균이 분리되었는데 EHEC 3건 모두 동거 가족에서 검출되었으며, 이 중 1명은 어린이집 노출이 없어 가족 내 개별 사례로 보고 EPEC를 원인 병원체로 추정할 수 있었다.
경기도의 집단식중독과 산발적 환자 발생에서 분리한 병원성대장균의 월별 경향을 살펴보면 기온이 높은 6~9월에 전체의 91.4%가 분리되어 여름철에 집중되는 계절성을 보였다 (Fig. 1A). 병원성대장균 종별로는 EHEC는 7월(60.4%), EPEC는 8월(40.3%), ETEC는 6월(58.5%), 그리고 EAEC는 9월(72.9%)에 가장 높은 분리율을 보였다. EAEC의 경우 다른 병원성대장균과는 다르게 9~11월에 88.1%가 분리되어 다소 늦게 분리되는 경향을 보였다. 병원성대장균에 의한 식중독 발생에서 기온과 강수량이 유의한 영향을 끼치는데 (21), 현재 우리나라는 기후변화가 빠르게 진행되고 있어 가을철에도 병원성대장균 식중독에 대한 각별한 주의가 필요할 것으로 판단된다.
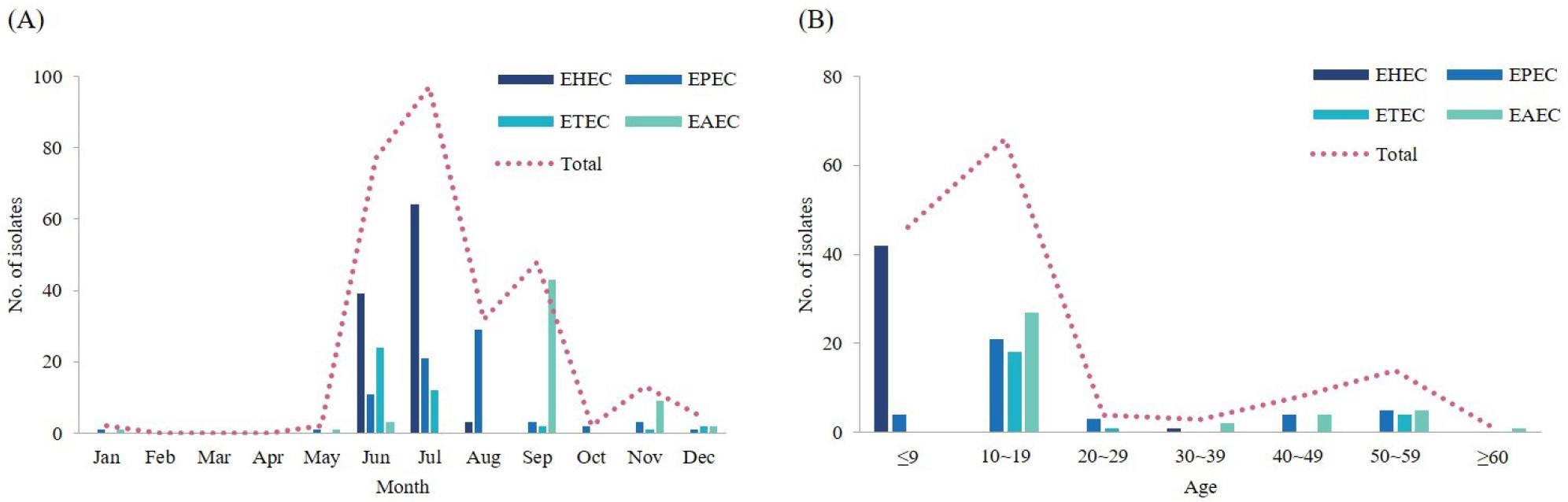
Fig. 1
Seasonal variation (A) and age distribution (B) of pathogenic E. coli isolates from food-borne outbreak in Gyeonggi-do, Korea.
연령에 따른 분리 경향을 살펴보면 10~19세(46.5%)에서 가장 높았고 0~9세(32.4%)가 뒤를 이어 10대 이하가 전체의 78.9%를 차지하였다 (Fig. 1B). 이처럼 10대 이하가 환자의 주를 이루는 것은 학교와 어린이집의 단체 급식과 관련이 있다. 또한 50~59세는 9.9%가 분리되었는데, 이는 20대 이상 중에서 가장 높은 분리율로 모두 급식 조리 종사자였다. 주 연령층으로 나타난 10대 이하는 면역성이 낮아 감염에 취약하며 합병증으로 인한 사망률이 높다는 점에서 이들에 대한 주의 깊은 관리가 필요할 것이다.
병원성 유전자의 유형
분리된 균주의 병원성 유전자를 확인한 결과 EHEC에서는 vt2가 41건, vt1-vt2가 3건 검출되어 분리된 EHEC는 모두 vt2 유전자를 보유하는 것으로 나타났다 (Table 3). vt2는 용혈성요독증후군과 같은 증상 발현과 관련이 있는 유전자로, 발현 시 vt1에 비해 더 치명적인 증상이 나타날 위험이 크다고 보고된 바 있다 (22). EPEC의 경우 typical EPEC는 개발도상국에서 주로 발생하며, atypical EPEC는 선진국에서 주로 발생한다고 보고된 바 있다 (23). 국내 수인성·식품매개감염병 병원체 감시사업(Enter-Net)에서 수집한 EPEC의 97.4%가 atypical EPEC으로 나타난 결과와 비교하면 (24), 본 연구에서 분리된 EPEC는 typical EPEC (bfpA+)가 26건(68.4%), atypical EPEC (bfpA-, eaeA+)가 12건(31.6%)으로 typical EPEC가 더 많이 분리됨을 확인할 수 있었다. ETEC는 sth-lt 19건, stp 4건이 검출되어 분리된 ETEC는 모두 내열성 독소를 가지고 있었다. 이는 Jin(2013) 등이 2011년 서울에서 분리한 ETEC 34주에서 내열성 독소 유전자를 생산하는 균주가 81%로 가장 많다는 결과와 유사하였다 (9). EAEC는 모두 응집에 관여하는 유전자인 aggR이 검출되었다.
혈청형의 분포
O항원 응집반응으로 확인한 혈청형은 Table 4에 나타내었다. 주요 혈청형은 O157, O69, O98, O6로 전체 분리 균주의 80.0%를 차지하였다. 병원성대장균 균종에 따라 O157는 EHEC, O98은 EPEC, O6는 ETEC, O69는 EAEC로 확인되었는데 모두 집단식중독 발생과 관련이 있었다. 그 외에 O110, O169, O175가 각각 3건(2.1%)이었고 O2, O171, O49, O92가 각각 2건(1.4%)이었다. O153, O37, O66, O119, O88, O51은 각각 1건(0.7%)이었으며 6건(4.2%)은 항혈청을 이용한 응집법으로 분석되지 않았다.
Table 4.
Distribution of O-serogroups in pathogenic E. coli isolates from food-borne outbreak in Gyeonggi-do, Korea
| O-serogroup | No. of isolates |
Total (%) (n = 144) | |||
|---|---|---|---|---|---|
| EHEC | EPEC | ETEC | EAEC | ||
| O157 | 43 | 43 (29.9) | |||
| O69 | 28 | 28 (19.4) | |||
| O98 | 25 | 25 (17.4) | |||
| O6 | 19 | 19 (13.2) | |||
| ONT* | 6 | 6 (13.2) | |||
| O110 | 3 | 3 (2.1) | |||
| O169 | 3 | 3 (2.1) | |||
| O175 | 3 | 3 (2.1) | |||
| O2 | 1 | 1 | 2 (1.4) | ||
| O171 | 2 | 2 (1.4) | |||
| O49 | 2 | 2 (1.4) | |||
| O92 | 2 | 2 (1.4) | |||
| O153 | 1 | 1 (0.7) | |||
| O37 | 1 | 1 (0.7) | |||
| O66 | 1 | 1 (0.7) | |||
| O119 | 1 | 1 (0.7) | |||
| O88 | 1 | 1 (0.7) | |||
| O51 | 1 | 1 (0.7) | |||
2010년부터 2019년까지 수인성∙식품매개감염병 병원체 감시를 통해 수집한 병원성대장균의 주요 혈청형(O157, O103, O26, O111, O91)과 본 연구 결과와 비교했을 때 (24), O157을 제외하고 분포가 다르게 나타났다. 이는 경기도 내 집단식중독에서 분리된 다양한 균종의 병원성대장균을 대상으로 한 이번 연구와는 다르게, 국내 주요 혈청형은 전국 병의원에 내원한 개별적 설사 환자에서 유래된 장출혈성대장균을 대상으로 분석했기 때문으로 생각된다. 따라서 국내 여러 종류의 병원성대장균을 대상으로 혈청형을 분석한다면 경향성을 비교할 수 있을 것으로 판단된다.
항생제 감수성의 특성
항생제 오남용으로 인한 내성균의 증가는 세균성 질환의 치료 효과를 낮출 뿐 아니라 약제 선택을 어렵게 하여 공중보건학적으로 큰 문제가 되고 있다 (25, 26). 이에 본 연구는 병원성대장균 144주에 대하여 17종의 항생제를 대상으로 감수성 검사를 시행하였다 (Table 5). 항생제별 내성을 확인했을 때 ampicillin과 nalidixic acid에 내성을 나타내는 균주가 각각 47건(32.6%)으로 가장 많았다. Kim(2014) 등은 2010년부터 2012년까지 경기도 내 학교급식 식중독 사고로부터 분리한 병원성대장균의 항생제 내성을 분석한 결과 ampicillin과 nalidixic acid에 각각 40%, 37% 내성을 보여 가장 높은 내성률을 보고하여 본 연구 결과와 유사하였다 (27). 그 밖에 cefalotin 내성이 36주(25.0%), cefazolin 내성 33주(22.9%), amoxicillin/clavulanic acid와 cefoxitin 내성이 각각 32주(22.2%), trimethoprim/ sulfamethoxazole 내성 26주(18.1%), tetracycline 내성 23주(16.0%), ampicillin/sulbatam 내성이 12주(8.3%)이었다. Kim(2014) 등에서 cephalosporin 계열의 1세대 항생제인 cefalotin과 cefazolin에 대해 각각 3%의 낮은 내성률을 보인 것과 달리 본 연구에서는 각각 25.0%와 22.9%로 다소 높은 내성률을 보였다 (27). Chloramphenicol, cefotaxime, ceftriaxone, gentamicin, ciprofloxacin, cefotetan에는 각각 3주(2.1%), 2주(1.4%), 2주(1.4%), 2주(1.4%), 2주(1.4%), 1주(0.7%)이 내성을 보였으며 imipenem과 amikacin에 대해서는 모든 균주가 감수성을 나타냈다.
Table 5.
Antimicrobial resistance of pathogenic E. coli isolates from food-borne outbreak in Gyeonggi-do, Korea
전반적으로 ampicillin, nalidixic acid, trimethoprim/sulfamethoxazole, 그리고 cephalosporin 계열의 1세대 항생제인 cefalotin, cefazolin와 같이 오래된 항생제에 대한 내성률은 높았던 반면, cephalosporin 계열 3세대 항생제에 대한 내성은 비교적 낮은 양상을 보였다. 즉 항생제를 사용한 기간이 길수록 내성을 획득한 병원성대장균이 많기 때문에 향후 항생제 사용에 있어 지속적인 관리가 필요할 것으로 생각된다.
병원성대장균의 종류별로 항생제 내성 정도에 차이가 있었으며, 동일 집단식중독에서 유래된 원인균이더라도 다양한 내성 양상을 가지고 있었다. EHEC, EPEC, ETEC, EAEC는 각각 4종, 9종, 13종, 11종의 항생제에 내성을 보여 ETEC가 가장 다양한 항생제에 내성을 나타냈다. EHEC는 tetracycline에 대한 내성률이 가장 높았으며, EPEC는 nalidixic acid와 trimethoprim/sulfamethoxazole에 대한 내성률이 가장 높았다. ETEC는 ampicillin, cefalotin, cefazolin, nalidixic acid, tetracycline에 대해 내성률이 높았다. EAEC는 병원성대장균 중에서 내성률이 가장 높아 전체 분리 균주의 내성률에 대한 비중이 가장 높았다. EAEC는 ampicillin, cefalotin, nalidixic acid에 대해 내성 균주가 많았으며, 이는 전체 분리 균주의 경향과 일치하였다. 본 연구와 유사하게 EAEC는 다른 설사 유발 병원성대장균에 비해 내성 균주가 많다고 알려져 있다 (28, 29). 항생제 내성률은 항생제의 사용량과 비례하여 증가하는데 (30), EAEC에 감염되면 설사가 지속됨에 따라 더 다양한 항생제에 노출되어 내성을 획득할 가능성이 높기 때문이라 추정할 수 있다.
다제내성 양상
병원성대장균의 다제내성 양상을 살펴보면 분리 균주 144건 중 58건(40.3%)은 한 개 이상의 항생제에 내성을 보였고, 나머지 86건(59.7%)은 모든 항생제에 감수성을 나타냈다 (Table 6). 총 23개의 다제내성 양상이 분석되었는데, EHEC, EPEC, ETEC, EAEC에서 각각 3개, 6개, 6개, 10개의 양상을 보였다. 이를 통해 EAEC가 다른 병원성대장균에 비해 항생제 내성률이 더 높음과 동시에 다제내성 유형이 다양함을 확인하였다.
Table 6.
Antimicrobial resistance patterns of pathogenic E. coli isolates from food-borne outbreak in Gyeonggi-do, Korea
| No. of antibiotics | Patterns | No. of resistant isolates |
Total (%) (n = 58) | |||
|---|---|---|---|---|---|---|
| EHEC | EPEC | ETEC | EAEC | |||
| 1 | AM | 1 | 1 (1.7) | |||
| CF | 1 | 1 (1.7) | ||||
| TE | 1 | 1 | 2 (3.4) | |||
| 2 | NA-SXT | 3 | 3 (5.4) | |||
| NA-TE | 1 | 1 (1.7) | ||||
| NA-CIP | 1 | 1 (1.7) | ||||
| AM-SAM | 1 | 1 (1.7) | ||||
| 3 | AM-NA-TE | 1 | 2 | 3 (5.4) | ||
| TE-C-SXT | 3 | 3 (5.4) | ||||
| 4 | AM-SAM-TE-SXT | 1 | 1 (1.7) | |||
| AM-SAM-NA-TE | 2 | 2 (3.4) | ||||
| 5 | AM-SAM-NA-TE-SXT | 2 | 2 (3.4) | |||
| AM-SAM-CF-NA-TE | 1 | 1 (1.7) | ||||
| 6 | AM-SAM-GM-NA-TE-SXT | 2 | 2 (3.4) | |||
| AM-AMC-CF-CZ-FOX-NA | 18 | 18 (31.0) | ||||
| 7 | AM-AMC-SAM-CF-NA-TE-SXT | 1 | 1 (1.7) | |||
| AM-AMC-CF-CZ-FOX-TE-SXT | 1 | 1 (1.7) | ||||
| AM-CF-CZ-CTX-CRO-NA-SXT | 1 | 1 (1.7) | ||||
| AM-AMC-CF-CZ-FOX-NA-SXT | 9 | 9 (15.5) | ||||
| 8 | AM-AMC-CF-CZ-FOX-NA-TE-SXT | 1 | 1 (1.7) | |||
| AM-AMC-SAM-CF-CZ-FOX-TE-SXT | 1 | 1 (1.7) | ||||
| 9 | AM-SAM-CF-CZ-CTT-FOX-NA-CIP-TE | 1 | 1 (1.7) | |||
| 10 | AM-AMC-CF-CZ-FOX-CTX-CRO-NA-TE-SXT | 1 | 1 (1.7) | |||
AM, Ampicillin; CF, Cefalotin; TE, Tetracycline; NA, Nalidixic acid; SXT, Trimethoprim/Sulfamethoxazole; CIP, Ciprofloxacin; SAM, Ampicillin/Sulbatam; C, Chloramphenicol; GM, Gentamicin; AMC, Amoxicillin/Clavulanic Acid; CZ, Cefazolin; FOX, Cefoxitin; CTX, Cefotaxime; CRO, Ceftriaxone; CTT, Cefotetan.
병원성대장균 종류별로 나타난 양상을 비교했을 때 EHEC에서는 TE-C-SXT가 5.4%, EPEC에서는 NA-SXT가 5.4%로 가장 많이 나타났다. ETEC 다제내성균으로 나타난 6건은 양상이 모두 달랐는데 이 중 5건은 7종 이상의 항생제에 내성을 보였다. 다제내성 양상 중에서 가장 많이 확인된 AM-AMC-CF-CZ-FOX-NA (31.0%)와 AM-AMC-CF-CZ-FOX-NA-SXT (15.5%)는 모두 동일 식중독에서 유래된 EAEC에서 나타난 것이었다.
내성 유전자의 검출 현황
병원성대장균의 항생제 내성 유전자 유무를 살펴본 결과, 144균주 중 40주(27.8%)는 항생제 내성 유전자가 검출되지 않았으며, 104주(72.2%)에서 하나 이상의 항생제 내성 유전자가 검출되었다 (Table 7). blaCTX-M은 74주(51.4%)에서 확인되어 가장 높은 검출률을 보였고, sul1, qnrB, tetA는 각각 40주(27.8%), 34주(23.6%), 20주(13.9%)에서 검출되었다. sul2, blaTEM, qnrS는 각각 12주(8.3%), 10주(6.9%), 8주(5.6%)에서 검출되었고, qnrA, tetB, blaOXA는 각각 5주(3.5%), 5주(3.5%), 3주(2.1%)의 낮은 검출률을 보였다. blaTEM, blaCTX-M, tetA, sul1, sul2는 모든 병원성대장균 유형에서 검출되었으나, 다른 내성 유전자는 유형별로 검출되는 유전자 보유율이 달랐다. EHEC와 EPEC는 blaCTX-M이 가장 많았고, ETEC와 EAEC는 qnrB를 가장 많이 보유하고 있었다. 특히 EAEC는 다른 유형에 비하여 내성 유전자가 가장 많이 검출되어 높은 항생제 내성률 결과와 일치하였다.
Table 7.
Antimicrobial resistance genes in pathogenic E. coli isolates from food-borne outbreak in Gyeonggi-do, Korea
항생제 내성이 내성 유전자 검출과 연관성이 있는지를 확인하기 위하여 항생제별 감수성 균주의 내성 유전자 검출률과 내성 균주의 내성 유전자 검출률을 비교하였다. 그 결과 양 집단 간 검출률에 유의한 차이를 보이는 유전자를 확인하였다 (Table 8). Penicillin 계열 항생제에 감수성인 병원성대장균은 모두 blaTEM과 blaOXA 유전자를 가지고 있지 않았으나, 내성 균주에서는 각각 21.3%, 6.4%가 검출되어 유의성이 있음을 확인하였다. 그러나 blaCTX-M은 penicillin 계열 항생제의 감수성 균주와 내성 균주에서 각각 47.4%, 59.6% 검출되어 큰 차이가 없었다. Penicillin과 같은 β-lactam 계인 cephalosporin 계열 항생제의 경우, 감수성 균주와 내성 균주 간 내성 유전자 검출에 유의적 차이를 보이는 유전자는 blaOXA와 blaCTX-M으로, blaOXA는 감수성 균주에서 검출되지 않았으나 내성 균주에서 8.3% 검출되었으며 blaCTX-M은 감수성 균주에서 46.3% 검출되었고 내성 균주에서 66.7% 검출되었다. blaTEM의 경우에는 뚜렷한 차이가 관찰되지 않았다.
Table 8.
Correlation between antimicrobial resistance and carriage of resistance genes in pathogenic E. coli isolates from food-borne outbreak in Gyeonggi-do, Korea
| Class of antibiotics | Susceptible isolates | Resistant isolates | ||||
|---|---|---|---|---|---|---|
| No. of isolates (%) | Resistance gene | No. of isolates (%) | No. of isolates (%) | Resistance gene | No. of isolates (%) | |
| Penicillin | 97 (67.4) | blaTEM | 0 (0.0) | 47 (32.6) | blaTEM | 10 (21.3)** |
| blaOXA | 0 (0.0) | blaOXA | 3 (6.4)* | |||
| blaCTX-M | 46 (47.4) | blaCTX-M | 28 (59.6) | |||
| Cephalosporin | 108 (75.0) | blaTEM | 8 (7.4) | 36 (25.0) | blaTEM | 2 (5.6) |
| blaOXA | 0 (0.0) | blaOXA | 3 (8.3)** | |||
| blaCTX-M | 50 (46.3) | blaCTX-M | 24 (66.7)* | |||
| Quinolone | 97 (67.4) | qnrA | 4 (4.1) | 47 (32.6) | qnrA | 1 (2.1) |
| qnrB | 3 (3.1) | qnrB | 31 (66.0)** | |||
| qnrS | 1 (1.0) | qnrS | 7 (14.9)** | |||
| Tetracycline | 121 (84.0) | tetA | 1 (0.8) | 23 (16.0) | tetA | 19 (82.6)** |
| tetB | 0 (0.0) | tetB | 5 (21.7)** | |||
| Sulfonamide | 118 (81.9) | sul1 | 19 (16.1) | 26 (18.1) | sul1 | 21 (80.8)** |
| sul2 | 4 (3.4) | sul2 | 8 (30.8)** | |||
β-Lactam 계 항생제는 세균의 세포벽 합성을 저해하는 물질로 세균성 질환 치료에 폭넓게 이용되는데, 광범위한 β-lactam 계 항생제에 작용하는 β-lactam 가수분해 효소(extended-spectrum β-lactamase, ESBL)를 가진 대장균이 많이 출현하고 있다 (31). 특히 ESBL 유전형 가운데 CTX-M은 3세대 cephalosporin계 항생제인 cefotaxime을 가수분해하며, 다양한 변이주들이 전 세계적으로 보고되고 있다 (32, (33, (34). 본 연구에서 blaCTX-M이 가장 많이 검출되었으며, cephalosporin계 항생제에 내성을 보이지 않아도 46.3%로 다소 높은 검출률을 보였기 때문에 앞으로 내성으로 발현할 가능성이 높다고 보여진다.
Quinolone 계열 항생제와 관련된 내성 유전자인 qnrA, qnrB, 그리고 qnrS에 대해 감수성 및 내성 균주 사이의 유전자 검출률을 비교한 결과, qnrA는 큰 차이가 없었고 qnrB와 qnrS에서 유의미한 차이를 나타내었다. 감수성 균주는 qnrB와 qnrS를 각각 3.1%, 1.0% 보유하고 있었고 내성 균주는 각각 66.0%, 14.9%를 보유하고 있어 병원성대장균의 quinolone 계열 항생제 내성에 qnrB와 qnrS가 크게 기여한다고 추정할 수 있다. Tetracycline 계열 항생제에 대하여 내성 균주 모두 tetA 또는 tetB 유전자를 하나 이상 가진 것으로 나타났으며, 감수성 균주와 내성 균주에서 tetA와 tetB의 보유율을 비교했을 때 각각 82.6%, 21.7%로 내성 균주의 보유율이 훨씬 높았다. 본 연구에서 tetA가 tetB보다 많이 검출되었는데 Kim(2009) 등의 연구에서도 tetracycline 내성 병원성대장균이 tetB보다 tetA를 더 많이 보유한 것으로 확인된 바 있다 (35). 또한 내성 균주 23건 모두 tetA 또는 tetB 유전자를 하나 이상 가진 것으로 나타났다. 따라서 병원성대장균의 tetracycline 저항성에 있어 tet 유전자가 필수적이라 할 수 있다. Sulfonamide 계열 항생제에 대해서도 유사한 결과를 나타냈는데 sul1과 sul2 검출률은 감수성 균주에 비하여 내성 균주에서 훨씬 높았으며 내성 균주 26건 중 23건에서 sul1 또는 sul2 유전자가 검출되었다.
본 연구에서는 병원성대장균이 내성 유전자를 보유하고 있는지 확인하였지만 내성 유전자와 항생제 내성의 인과관계를 추론하기 위해서는 실제로 내성 유전자가 발현되어 내성을 일으키는지 과정을 면밀히 살펴볼 필요가 있다고 생각된다. 또한 약제 별 내성 유전자가 다양하기 때문에 더 많은 유전자를 확인하고 작용부위의 변이 여부도 추가로 분석한다면 추후 항생제 저항성이 높은 병원성대장균에 대한 대응책을 마련하는데 도움이 될 것으로 판단된다.
CONCLUSION
2020년부터 2022년까지 경기도의 집단식중독 환자로부터 분리한 병원성대장균 144주를 대상으로 분리 경향을 파악하고 병원성 유전자 및 혈청형 분포를 조사하였으며, 항생제 내성률과 항생제 내성 유전자 등 다양한 특성을 분석하였다. 이는 향후 식중독 안전관리 대책을 수립하고 항생제 적용에 관한 기초자료로 활용할 수 있을 것이다.
1. 최근 3년간 경기도에서 발생한 집단식중독 8건에서 EHEC 44주, EAEC 39주, EPEC 38주, ETEC 23주를 분리하였으며 어린이집, 학교와 회사 등 단체 급식과 관련하여 발생하였다.
2. 병원성대장균은 주로 하절기에 분리되는 계절적인 특성이 뚜렷하게 나타났다. 연령에 따른 분리율은 학교와 어린이집 단체 급식과 관련된 10대 이하가 78.9%로 가장 우세하였다.
3. 병원성 유전자를 분석한 결과, EHEC는 모두 용혈요독증후군과 같은 증상 발현과 관련이 있는 vt2 유전자를 보유하였다. EPEC의 경우 atypical EPEC (bfpA-, eaeA+)에 비하여 typical EPEC (bfpA+)가 더 많이 분리되었다. ETEC는 모두 내열성 독소를 가지고 있었으며, EAEC에서는 모두 aggR이 검출되었다.
4. 병원성대장균의 주요 혈청형은 O157, O69, O98, O6이었으며, O157은 EHEC, O98은 EPEC, O6은 ETEC, O69는 EAEC로 나타났다.
5. 항생제 감수성을 확인한 결과, 병원성대장균은 ampicillin과 nalidixic acid에 높은 내성을 나타냈으며, 전반적으로 오래 사용한 항생제들에 대해 내성률이 높았다. ETEC는 가장 다양한 항생제 내성 양상을 나타냈고, EAEC는 다른 병원성대장균에 비해 내성 균주가 많았다.
6. 병원성대장균에서 총 23개의 다제내성 양상이 분석되었다. 다제내성 양상 중에서 가장 많이 확인된 AM-AMC-CF-CZ-FOX-NA와 AM-AMC-CF-CZ-FOX-NA-SXT는 동일 집단식중독에서 유래한 EAEC에서 나타난 것이었다.
7. 병원성대장균의 항생제 내성 유전자 분석 결과, 72.2%에서 하나 이상의 내성 유전자가 검출되었다. 가장 많은 내성 유전자는 blaCTX-M이었고, sul1, qnrB, tetA 순이었다.
8. 항생제 감수성 균주와 내성 균주의 내성 유전자 검출률을 비교한 결과, penicillin 계열에서 blaTEM과 blaOXA가, cephalosporin 계열에서 blaOXA와 blaCTX-M이, quinolone 계열에서 qnrB와 qnrS이 유의미한 차이를 나타내었다. 또한 tetracycline 계열에서 tetA와 tetB가, sulfonamide 계열에서는 sul1과 sul2가 유의성 있는 결과를 보였다.




