INTRODUCTION
노로바이러스는 전 연령대에 급성 위장염을 일으키는 매우 중요한 병원체로, 세계적으로 급성 장염(acute gastroenteritis;AGE)의 ≈20% 정도를 차지한다 (1). 특히 5세 미만의 영유아에게 끼치는 영향이 매우 커서, Centers for Disease Control and Prevention (CDC) 자료에 의하면 매년 개발도상국 아이들 50,000명 정도가 노로바이러스 감염으로 사망한다는 보고가 있다 (2). 어린이가 2세가 되면 아마도 1번 이상 노로바이러스 감염에 노출될 될 가능성이 있으며, 이 연령대의 어린이들은 증상이 심각하고, 장기간 증상이 유지되고, 여러 가지 종류의 노로바이러스에 의한 감염될 위험이 있다 (3, 4, 5).
노로바이러스는 매우 전염성이 강해 20개 미만의 매우 소량의 바이러스만으로도 감염을 일으킬 수 있다 (6). 감염 후 24~48시간 이내에 복통, 메스꺼움, 구토, 설사 등을 동반한 증상이 나타난다. 이러한 증상은 2~3일간 지속되다가 사라지게 되는 것이 일반적이나 일부 환자에서는 두통이나 오한, 근육통 등을 유발하기도 한다 (7). 노로바이러스에 감염 시 나타나는 주증상이 구토이기 때문에 노로바이러스를 위 감기(stomach flu)라 부르기도 한다.
노로바이러스는 오염된 식품, 물(지하수)을 매개로 하여 식중독 증상을 유발한다고 알려져 있지만, 사람 대 사람 접촉(62-84%)을 통해 주로 감염될 수 있고, 오염 된 표면이나 감염된 사람의 구토물에서 공기를 통해 퍼질 수 있다 (8). 노로바이러스에 의해 감염된 사람들의 구토 시 에어로졸, 설사 시 변기 에어로졸로도 감염될 수 있다 (9). 또한 조개류는 노로바이러스 발병과 밀접하게 관련된 식품으로, 충분히 가열하지 않고 섭취하면 노로바이러스 감염 위험이 높다. 현재까지 알려진 백신이나 치료제는 없으므로, 올바른 손 씻기와 오염된 표면의 적절한 소독으로 예방하는 것이 중요하다.
Caliciviridae로 분류되는 노로바이러스는 positive-sense single strand RNA로 유전체 크기는 7.5kb 정도이며, 3개의 open reading frame (ORF)로 구성되어 있다 (10). ORF1은 RNA dependent RNA polymerase (RdRp), helicase, VPg, protease등 바이러스 복제에 필요한 단백질을 암호화하고 있고, ORF2는 캡시드 단백질(VP1)을 암호화하고 있으며, ORF3는 ORF2에 의해 합성된 캡시드 단백질의 안정화를 위한 보조적인 역할을 수행하는 구조 단백질(VP2)를 전사한다 (11). 노로바이러스의 genogroup은 RdRp 및 VP1 capsid 단백질의 다양성에 따라 GI~GⅩ형의 10가지 종류로 구분되며, 이 중 GI, GII, GIV형이 사람에게 감염되는 원인체로 알려져 있다. Genotype은 GI형 9종, GII형 26종, GIV형 2종 등 48종 이상이 보고되고 있다 (12). 최근의 노로바이러스 분류는 중합효소(RdRp) 부분을 타이핑하게 업데이트 되었는데, 60개 이상의 중합효소 유형(P-type)으로 분류된다 (12).
현재까지 보고된 연구에 의하면 전 세계적으로 지역과 기간을 막론하고, 사람에게서 가장 많이 검출되는 노로바이러스는 GII 유전형이다. 노로바이러스 GII의 다양한 genotype 중 GII-4는 GII-3 바이러스가 지배적이었던 1990년대 중반 이후 전 세계적인 우세종이다 (13, 14). 새로운 GII-4 변종의 출현은 세계적으로 노로바이러스의 유행과 밀접한 관련이 있을 것으로 추정되며 2009년에는 GII-4 New Orleans, 2012년에는 GII-4 Sydney 등 2~3년마다 GII-4 변이체가 등장하였다 (15). 현재 GII-4 Sydney가 6개 대륙 모두에서 가장 흔하며 52% 정도 검출된다고 보고되고 있다 (16). 이러한 GII-4 변종이 정기적으로 출현하여 전 세계로 퍼져 특히 의료 환경에서 질병과 사망을 증가시키는 데 기여하고 있다 (17).
GII-4 균주가 모든 연령대에서 발견되는 가장 흔한 균주이지만 GII-2, GII-3 및 GII-6 바이러스와 같은 비 GII-4 균주는 어린 아이들 사이에서 감염을 일으키는 원인이다 (18, 19, 20). 희귀 균주 및 GII-4 변종은 모든 연령대에 전 세계적으로 퍼지기 전에 어린이들 사이에서 수년 동안 유행할 수 있다고 보고되고 있다 (21). 결과적으로 집단 면역이 거의 존재하지 않는 어린이들의 경우 노로바이러스의 유행 경향 분석 및 새로운 변이주 출현을 감시하는데 중요한 집단이 될 수 있다. 이에 본 연구에서는 경기지역에서 2019년부터 2021년까지 발생한 식중독 중 노로바이러스 검출률이 가장 높은 어린이집 식중독 노로바이러스의 유전형을 분석하여 국내 유행 양상을 파악하고, 이를 토대로 경기지역 식중독 예방 대책 수립의 기초 자료를 제공하고자 하였다.
METHODS
환자검체 수집 및 검체 처리
본 연구에서는 2019년 1월부터 2021년 12월까지 3년간 경기지역 남부 21개 시․군 보건소에서 어린이집 집단 식중독 발생 시 의뢰된 검체를 사용하였다. 환자 및 종사자, 환경 검체 994건(2019년 246건, 2020년 46건, 2021년 702건)을 조사 대상으로 연구하였다. 직장 도찰(rectal swab) 경우 멸균된 0.1 M PBS (phosphate buffered saline) 1.5 ㎖에 넣고, 분변(stool)일 경우 분변 1 g을 0.1M PBS 9 ㎖에 넣어 희석하였다. 희석된 검체는 3분간 vortex한 후 면봉은 제거하고, 4℃, 6,000 rpm에서 10분간 원심 분리하였다. 상층액을 취해 새로운 튜브에 옮겨 소분한 뒤 RNA 추출에 사용하였고, 보관은 -70℃ 초저온 냉동고에 하였다.
노로바이러스 RNA추출 및 유전자 검출
노로바이러스의 RNA 추출은 Genolution사의 NX48 장비를 이용하였다. 분변 검체 200 ㎕를 NX-48 Viral NA Kit (Genolution, VN111)을 사용하여 추출하였고, 추출된 RNA는 사용할 때까지 -70℃에서 보관하였다. 노로바이러스 양성 여부를 확인하기 위해 Norovirus GI/GII multiplex PCR kit (Kogene, IR1200F)와 Norovirus GI or GII detection kit (Kogene, P0203C or P0205C)를 사용하여 제조사 실험 조건에 따라 유전자 분석을 수행하였다.
염기서열 분석 및 유전계통학적 분석
질병관리청 바이러스분석과에서 제공하는 primer 염기서열 및 실험 조건에 따라 노로바이러스 유전자를 검출하였다 (Table 1). Onestep RT-PCR를 위해 2X RT-PCR Master mix 13.5 ㎕, 10 pmole sense primer와 antisense primer 각각 1 ㎕, DW 4.5 ㎕, RNA 5㎕를 포함한 25 ㎕ 반응액을 사용하였다. 유전자 증폭을 위해 ProFlex 96well (Life technologies, Singapore) PCR 장비를 이용하여 42℃에서 30분간 reverse transcription 를 수행하고, 95℃ 15분 동안 반응시킨 뒤 95℃ 1분, 58℃ 1분, 72℃ 1분으로 45 cycles를 반복한 후 72℃에서 10분간 extension 하였다.
Table 1.
Oligonucleotide primers used in this study
RT-PCR을 통해 증폭된 PCR 산물은 바이오닉스(Korea)를 통해 정제와 유전자 분석을 수행하였다. 분석된 경기도내 노로바이러스 분리주의 nucleoprotein(N) 부위 염기서열은 BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi)을 이용하여 GenBank (http://www.ncbi.nlm.nih.gov) 데이터베이스에 등록되어 있는 기존의 노로바이러스 표준주 염기서열과 비교분석을 통해 가장 높은 상동성을 나타낸 유전형을 확인하였다. 서열들은 Clustal W program을 사용하여 정렬하였으며, MEGA v 6.06 (Molecular Evolutionary Genetics Analysis version 6.06) program을 이용하여 maximum composite likelihood model에 의해 염기서열간의 유전적 거리와 phylogenetic tree를 추론하였다. 또한, bootstrap 값은 1,000회의 resampled data로부터 추론하였다.
RESULTS
경기도내 노로바이러스 식중독 발생 양상
2019년부터 2021년까지 경기 남부 지역의 전체 식중독 발생 양상을 살펴보았다. 식중독 발생 사례 및 발생 건수는 2019년 99 사례(1,821건), 2020년 58 사례(1,029건), 2021년 97 사례, (1,545건)이었다. 2020년 코로나 대유행으로 식중독 신고 건수가 감소하였으나, 2021년에는 2019년과 유사한 수준으로 발생하였다.
3년간 전체 식중독 검체 4,395건 중 1,271건에서 병원체가 검출되어 양성률은 28.9%였다. 이중 노로바이러스 검출률은 18.3%(806건)로 전세계 급성장염의 20% 정도가 노로바이러스와 연관 있다는 보고와 유사하다 (1). 노로바이러스 양성 검출률은 2019년 14.9% (272건/1,821건), 2020년 7.5% (77건/1029건), 2021년 29.6% (457건/1,545건)였다. 2019년 대비 2021년에 노로바이러스 양성건수가 168% 증가하였다. 원인병원체별로 살펴보면 노로바이러스(63.4%), 병원성 대장균(16.3%), 살모넬라(8.7%) 순으로 노로바이러스가 가장 많이 검출되었다.
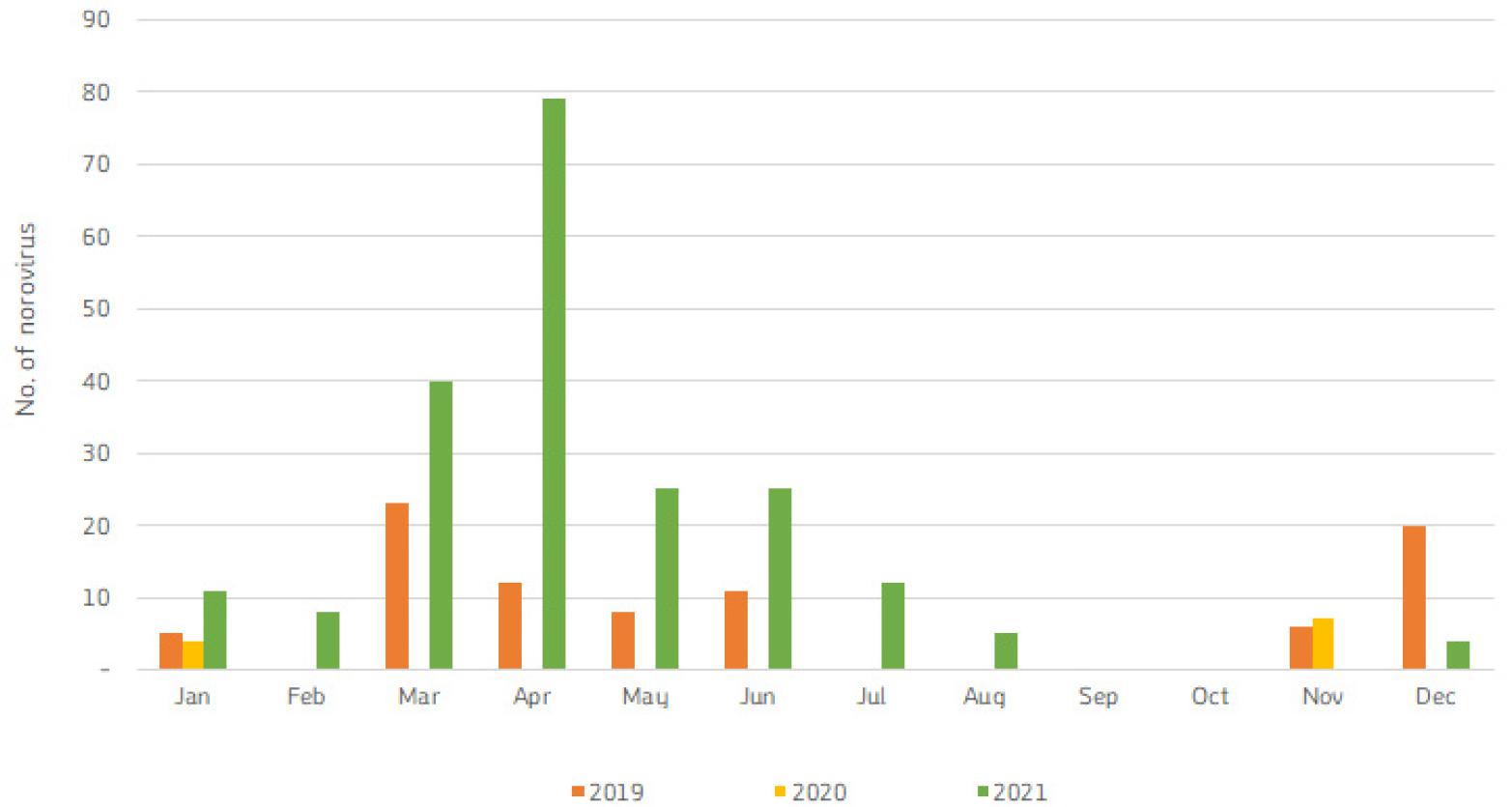
경기도내 전체 식중독에서 노로바이러의 계절별 발생 경향을 살펴보았다. 노로바이러스는 대표적인 겨울철 식중독 원인 병원체로 알려져 있지만, 11월과 12월에 검출되기 시작하여, 2021년에는 4월에 가장 양성률이 높았고, 2019년에는 3월에 가장 높았다 (Fig. 1). 이는 최근 노로바이러스 최고 검출 시점이 12월에서 1월로 이동하면서 늦봄(5월)까지 유행이 지속된다는 질병청 자료(질병관리청, 감염병 누리집)와 발생 경향이 유사하다.
어린이집 노로바이러스 식중독 발생 양상
2019년부터 2021년까지 경기도내 어린이집에서 신고 접수된 식중독에서 노로바이러스가 원인으로 밝혀진 경우는 94.8% (55건/58사례)로 압도적이였다. 반면 전체 식중독 발생 사례에서 노로바이러스가 원인인 경우는 47.6% (121건/254사례)였다 (Table 2). 노로바이러스 이외에는 로타바이러스, 병원성 대장균이 검출되었다.
Table 2.
No.(%) of norovirus outbreaks
| 2019 | 2020 | 2021 | Total | |
|---|---|---|---|---|
| Gyeonggi-Do |
48/99 (48.5%) |
12/58 (20.7%) |
61/97 (62.9%) |
121/254 (47.6%) |
| children of daycare center |
14/15 (93.3%) |
3/3 (100%) |
38/40 (95%) |
55/58 (94.8%) |
월별 노로바이러스 검출 양상을 살펴보면 2019년에는 11월부터 검출되기 시작하여, 늦은 봄인 5월~6월 검출되었고, 2020년 2월 코로나가 유행하던 시기여서, 식중독 발생이 일시적으로 감소하여 노로바이러스 검출률이 낮았다. 그러나 2021년에는 어린이집 식중독 신고가 급증하였고, 노로바이러스 검출률도 매우 높아졌다. 4월에 가장 높은 검출률 보이고, 여름인 7월~8월까지 검출되었다. 2019년과 2021년을 비교 분석해 보면 노로바이러스가 주로 겨울철에 유행한다는 기존 보고와 달리, 검출 시기가 점점 늦어지고 있다. 이러한 결과는 경기도내 전체 식중독에서 노로바이러스 검출 경향과 유사하다. 이는 어린이집에서 식중독이 발생한 경우 신고율이 높고, 노로바이러스 검출률이 높기 때문으로 추정된다.
어린이집 식중독 발생 경향을 지역별로 살펴보았다. 경기 남부 21개 시·군 중 성남, 광주, 여주, 이천, 군포시를 제외하고 16곳의 지역에서 어린이집 식중독이 발생하였다. 시·군별로 분석한 결과 가장 식중독 신고가 많이 된 지역은 화성, 안산, 평택, 시흥 등으로 해변가를 접한 지역이였고 (Table 3), 같은 지역에서 유사한 시기에 집중적으로 식중독 발생 신고되는 경우가 많았다.
Table 3.
Case of food poisoning outbreaks from 2019 to 2021 in Gyeonggi-Do by administrative districts
어린이집 노로바이러스의 분자유전학적 특성
2019년부터 2021년까지 경기도내 어린이집 식중독 환자의 검체에서 분리한 노로바이러스의 유전형 특성을 살펴보았다. 사람에게 감염되는 노로바이러스는 GI, GII, GIV형이지만, 현재 우리나라의 진단 기준은 GI, GII만을 확인 동정하고 있다. 노로바이러스가 원인 병원체로 밝혀진 55건의 사례 중 GI은 1건이며, 나머지 54건(98.2%)은 모두 GII형으로 확인되었다. 즉 어린이집 식중독 발생시 원인이 되는 노로바이러스 유전형은 대부분 GII형임을 확인하였다.
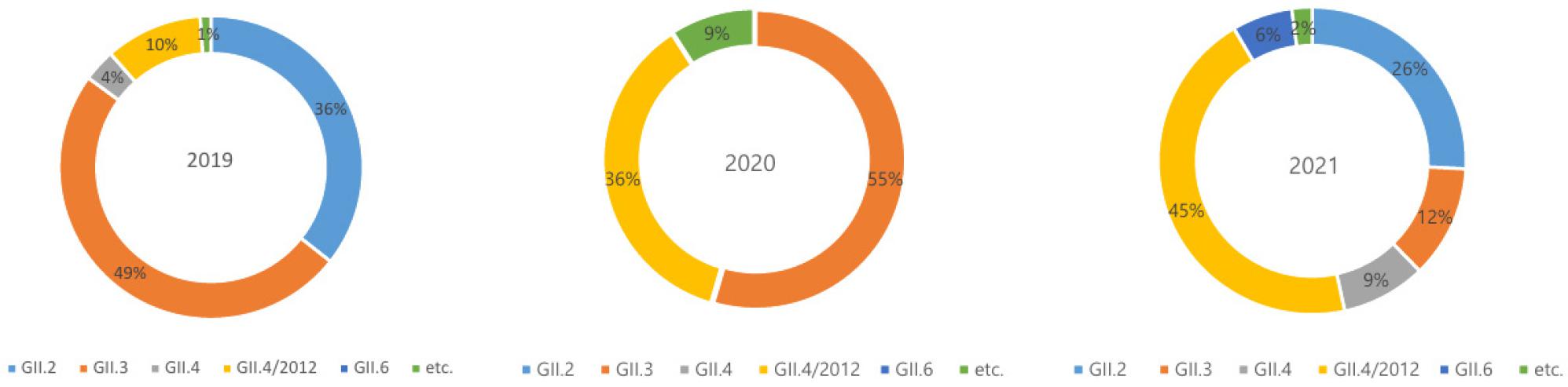
어린이집에서 검출된 노로바이러스의 염기서열 분석을 통해 유전형 분석을 하였다. GI형에서 2종(GI-3, 4), GII형에서 5종(GII-2, 3, 4, 6, 22)이 분포하고 있다. 이는 2019년~2021년 경기도 전체 식중독에서 검출되는 노로바이러스 유전형 중 GI형 4종(GI-1, 3, 4, 5), GII형 8종(GII-1, 2, 3, 4, 5, 6, 8, 17)보다 그 종류가 적었다. 어린이집에서 검출된 노로바이러스 GII 유전형의 세부 genotype은 주로 GII-2, GII-3, GII-4, GII-4/2012이며, 2021년에는 특이하게 GII-6에 의한 집단 발병이 처음으로 확인되었다 (Fig. 2). GII-6를 이중타이핑 명명법으로 분석해 본 결과 GII-6〔P7〕형이였다.
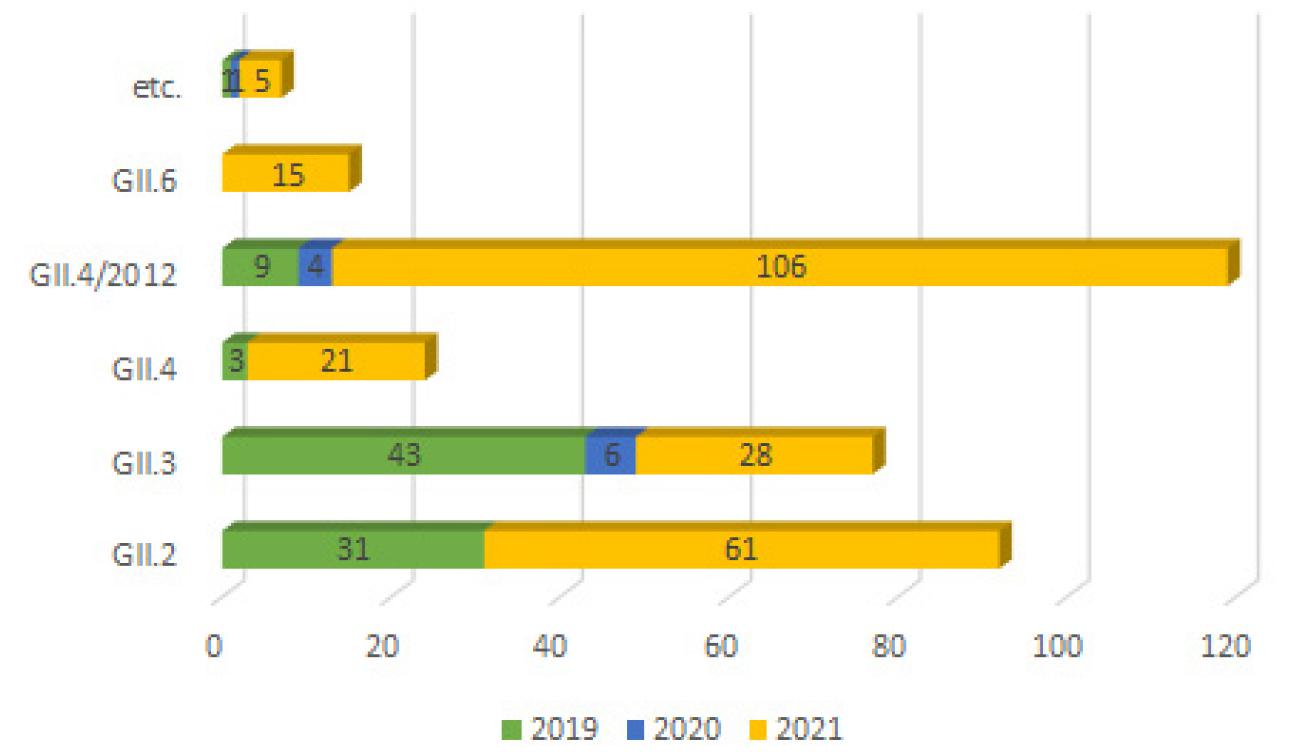
연도별로 자세히 살펴보면 2019년에는 GII-2가 먼저 검출된 후, GII-3가 뒤이어 유행하였다. 2020년에는 코로나 유행으로 식중독 발생 신고가 감소하였고, GII-3와 GII-4/2012가 유행하였다. 2021년에는 어린이집에서 노로바이러스가 많이 검출된 해로, GII-4/2012, GII-2, GII-3가 유행을 지속한 가운데, GII-6가 새롭게 검출되었다. 특이하게 2021년에는 GII-4/2012 와 다른 genotype (GII-2, GII-3, GII-4)이 동시에 검출되는 경우가 10건(26.3%) 있었다. 경기도내 어린이집에서 검출된 노로바이러스의 경우 GII-4/2012 (Sydney)가 119건으로 가장 많았고, GII-2 (92건), GII-3 (77건) 순으로 검출 되었다 (Fig. 3). 이들이 매년 순환하면서 유행을 지속한 가운데, 2021년 GII-4/2012 (Sydney)가 어린이집 영유아들 사이에서 유행을 주도하여, 노로바이러스 유전형 중 가장 높게 검출되었다.
GII-4/2012 변이주의 유전계통학적 분석
2012년에 GII-4/2012 (Sydney)가 출현한 이후 5세 미만의 아이들을 대상으로 한 연구(2016년~2020년)에서 GII-4/2012가 50% 정도를 차지하고, 그 다음으로 GII-2, GII-3, GII-6가 검출된다는 보고가 있다 (16). 이는 경기도에서 2019-2021년 3년동안 발생한 어린이집 식중독에서 검출된 노로바이러스 유전형을 분석한 결과와 매우 유사하다. 경기도의 경우도 GII-4/2012가 119건(35.6%)였고, 그 다음으로 GII-2, GII-3, GII-4, GII-6 순으로 검출되었다 (Fig. 3). 노로바이러스의 많은 유전형 가운데 어린이집 영유아들 사이에서 유행을 주도하는 유전형은 GII-4/2012, GII-2, GII-3, GII-6 등 임을 알 수 있다.
본 연구에서 어린이집에서 검출된 노로바이러스 중 가장 많이 검출된 GII-14/2012형에 대한 유전계통학적 분석을 수행하였다. GII-4/2012형으로 확인된 119건의 검체를 분석한 결과 크게 2종류의 cluster로 구분되었고, MN588303주와는 91,8%, KY407103주와는 99.6% 유사하였다. GII-4/2012형은 환자이외에 종사자와 환경검체(화장실 변기, 장난감, 문고리 등)에서 검출되었는데, 환자에서 분리한 분리주와 일치하였다 (Fig. 4). 환자는 P, 종사자는 FH, 환경검체는 E로 표기하여 구분하였다. 이는 집단 생활을 하는 영유아들 사이에서 노로바이러스가 화장실이나 놀이감, 종사자들을 통해 직간접적으로 전파될 가능성을 보여준다.
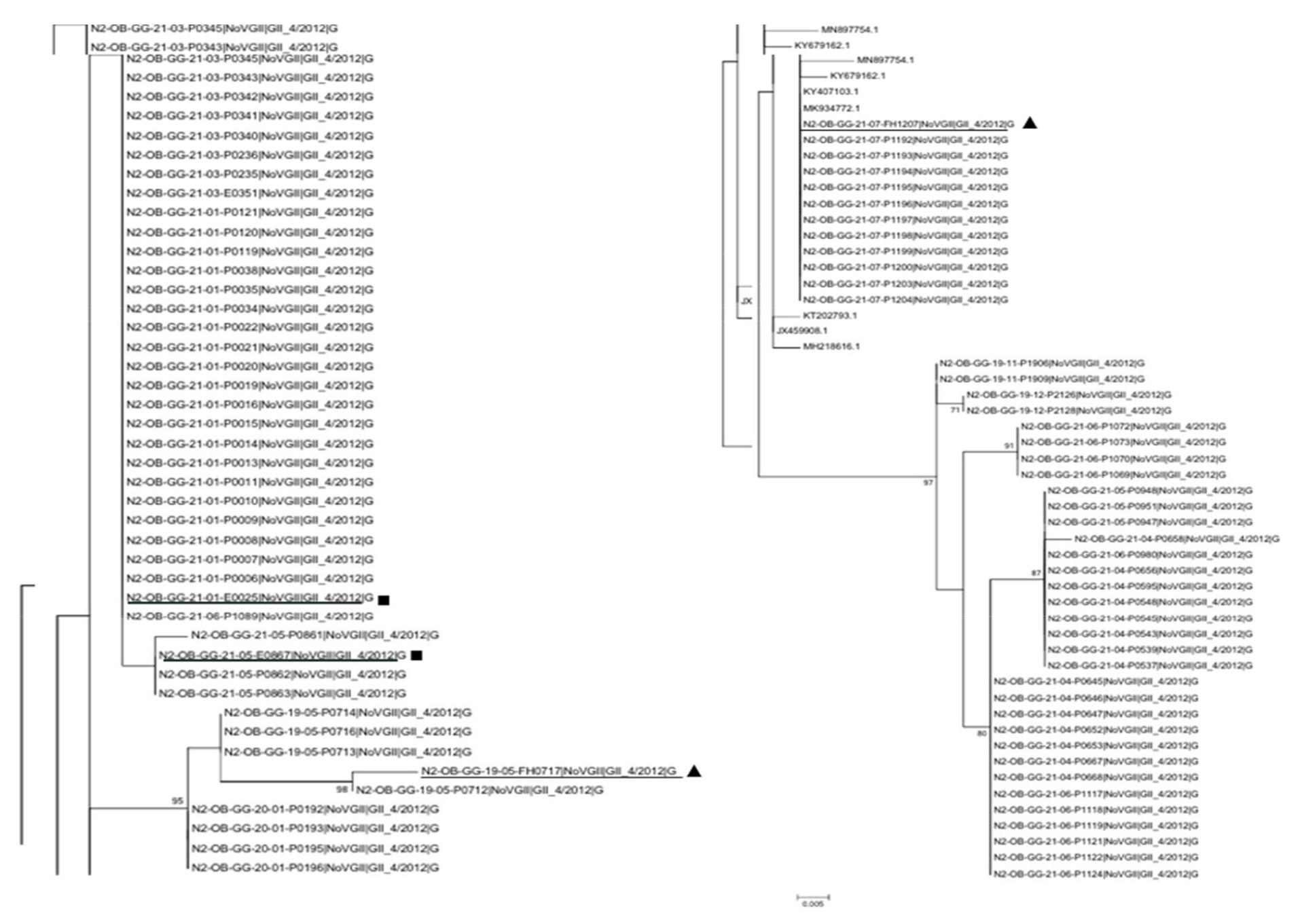
Fig. 4
Phylogenetic tree of noroviruse GII-4/2012. Nucleotide sequences were analyzed by using the maximum-likelihood method. Shown are trees with the highest log likelihood. Statistical evaluation was performed by 1,000 bootstrap replications. Closed square and triangle represent environment (toilet, doorknob) and worker, respectively.
DISCUSSION
어린이들의 경우 노로바이러스에 대한 내성이 없고, 구토가 주로 발생한다. 구토 시 비말, 이로 인해 오염된 환경, 화장실 에어로졸 등으로 감염될 가능성이 높다. 노로바이러스의 근본적인 오염원으로 알려진 지하수, 김치, 굴 등으로 인한 식중독은 보통 10가지 이상 다양한 노로바이러스 유전자형이 검출되는 반면, 어린이집 노로바이러스 식중독은 1가지 유전자형에 의해 유발되는 경우가 많아 사람 간 전파, 또는 오염된 환경을 통한 전파 가능성이 있음을 추정해 볼 수 있다. 2020년의 경우 코로나 대 유행으로 어린이집 휴원이 많았으며, 손씻기 등 개인 위생이 강화되어 식중독이 감소하였으나, 2021년에는 특이하게 어린이집에서 노로바이러스에 의한 집단 식중독이 폭발적으로 증가하였다. 이 시기 분리된 노로바이러스 유전형으로는 GII-14/2012가 가장 많았다. 어린이집 식중독에서 검출된 노로바이러스 중 가장 많은 GII-14/2012형(119건)에 대해 유전계통학적 분석을 수행한 결과 종사자와 환자, 환자와 환경 검체(화장실 변기, 문고리 등)에서 동시에 분리되었는데, 서로 유전형이 일치하였다. 또한 환자 중 보육교사에서도 동일한 유전형의 노로바이러스가 검출되는 경우도 많았다. 이는 GII-14/2012에 의한 개인간 전파, 또는 2차 전파가 일어날 수 있음을 보여주며 2021년 노로바이러스에 의한 식중독 증가가 GII-14/2012 유행과 연관성이 있을 가능성이 있다.
또한 경기도 내 어린이집 집단 식중독에서 주로 검출된 노로바이러스 유전형은 GII-4/2012가 가장 많았고, 그 다음으로 GII-2, GII-3, GII-4, GII-6 였는데, 이는 기존에 보고된 국제적 결과와 일치한다 (16). 경기도는 전국에서 가장 많은 식중독이 발생하며(식약처, 식품안전나라 통계), 특히 어린이집에서 발생하는 식중독은 노로바이러스가 원인 병원체로 검출되는 경우가 대부분이다. 전염력이 높은 노로바이러스 특성상 집단 감염을 물리적으로 완전히 막을 수는 없다. 하지만 어린이집에서 검출된 노로바이러스의 발생 경향, 유전적 특성의 분석 자료는 경기도 및 전국 유행 양상을 예측하는데 활용가치가 높다