INTRODUCTION
항생제 사용의 빈도가 늘어가면서 항생제 내성균의 출현은 해가 갈수록 전 세계적으로 점차 증가하고 있어 환자의 치료 및 감염 관리가 어려워지고 있다 (1, 2). 특히 카바페넴분해효소 생성 장내세균속균종(Carbapenemase-producing Enterobacterceae, CPE)에 의한 감염증은 2010년에 해외 유입으로 국내에서 처음 발생 된 이래로 국내뿐만 아니라 전 세계적으로 빈도가 증가하고 있어, 우리나라에서는 2010년 12월 법정감염병(지정감염병)으로 지정하여 표본감시체계로 운영하였고, 2015∼2016년 국내 집단 발생 이후, 2017년 6월 제3군감염병, 2020년 1월 감염병예방법 개정에 따라 제2급 감염병으로 변경되어 전수 감시체계로 운영되고 있다(3, 4, 5).
카바페넴은 β-lactam 계열 항생제 중 하나로, β-lactam 계열 항생제는 그람음성균에 뛰어난 효과를 보여 의료현장에서 가장 폭넓게 사용되고 있다. 카바페넴은 β-lactam 계열 항생제 중에서도 항균 영역이 가장 넓은 항생제로 의료현장에서 최종적으로 사용되고 있다 (6). 페니실린 및 세팔로스포린과 같이 페니실린 결합 단백질에 의해 미생물을 죽인다 (7). 카바페넴 내성의 주요 기전은 카바페넴을 분해하는 효소인 carbapenemase에 의한 항생제의 불활성화이다. 그람음성세균의 특성상 균주 간 유전자의 수평적 전이가 활발하게 이루어지기 때문에 CPE 감염증 환자의 경우 사람 간 전이로 인한 집단 발생의 위험이 높다. 뿐만 아니라 항생제 내성 유전자를 가지는 플라스미드의 경우 다른 항생제에도 내성을 유도할 수 있으므로 치료 항생제 선택에 제한을 가져오며 이는 내성이 없는 장내세균속 감염증과 비교하였을 때 병원 내 높은 환자 사망률과 의료비용 상승 등으로 경제적 손실을 유발한다 (8, 9).
CRE 분리균 중 Klebsiella pneumoniae (K. pneumoniae)가 전 세계적으로 많이 검출되고 있는 균종 중 하나이며, 국내의 경우 2021년도 국내 전체 CRE 감염증 중 68.6%를 차지하고 있다 (10). K. pneumoniae 카바페넴 분해효소 유전자는 주로 KPC (K. pneumoniae carbapenemase)으로 알려져 있고 전 세계적으로 75가지의 유전형을 갖고 있다. 우리나라를 포함한 아시아, 유럽, 미국의 경우 KPC-2형이 주로 나타나고 있다 (11).
전체인구 중 만 65세 이상 노인 비율이 14%를 넘으면 고령사회, 20%를 넘으면 초고령사회로 분류된다. 고령인구사회의 경우 종합병원, 요양병원 등 의료기관 이용이 많고, 이들 의료기관은 CRE 감염증 환자가 많이 모이는 장소로서 의료기관을 중심으로 환자 및 병원체 보유자, 오염된 환경 표면과 직접 또는 간접적인 접촉을 통해 CRE 감염증의 집단 발생이 일어나기 쉽다 (10, 12, 13). 따라서 의료기관 내에서 CPE 감염 확산을 막는 것이 CRE 감염 관리의 핵심이라고 할 수 있다 (6).
부산지역은 2015년에 14.6%였던 만 65세 인구비율이 2021년에는 20%를 넘겨 초고령사회로 진입하였으며, 부산의 초고령사회 진입은 7개 특별·광역시 중 처음이며 우리나라의 초고령사회 진입 시기보다 5년이 빠르다. 이에 본 연구에서는 2022년도 부산지역 소재 의료기관에서 검사 의뢰된 균주를 대상으로 장내세균속균종 분포, 카바페넴 4종 항생제 감수성 시험 및 카바페넴 분해효소 10종의 유전자 검출 검사를 통해 CRE 균주의 카바페넴 내성 경향, 내성 인자의 분포 현황 및 특성을 파악하여 의료기관 내 감염관리를 위한 기초 자료로 제공하고 그에 따른 관리대책 수립의 기반을 마련하고자 한다.
MATERIALS AND METHODS
연구대상
2022년 1월부터 12월까지 관내 상급종합병원, 종합병원, 요양병원 등 92개 의료기관에서 MacConkey agar 또는 blood agar에 계대 배양하여 검사 의뢰된 균주 2,429주를 대상으로 실험을 실시하였다.
연구방법
10종의 카바페넴 내성 유전자 검출 검사(KPC, K. pneumoniae carbapenemases; NDM, New Delhi metallo-β-lactamase; OXA, Oxacillinases; IMP, Imipenemase; VIM, Verona integron-mediated metallo-β-lactamase; GES, Guiana extended-spectrum; SPM, Sao Paulo MBL; SIM, Seul imipenemase; GIM, German imipenemase; SEM, Serratia marcescenes enzyme), 4종의 카바페넴 항생제 내성 검사(ertapenem, imipenem, doripenem, meropenem), Vitek 2 Compact (BioMerieux, Marcy I’Etoile, France) 장비를 이용하여 미생물이 가지고 있는 독특한 유전인자를 자동으로 분석하여 장내세균 여부 동정검사를 실시하였다.
균주의 동정
의료기관에서 의뢰된 균주를 카바페넴계 항생제에 내성인 장내세균을 색깔별로 분리 검출 가능한 CHROM KPC agar (Hankang Media Co., Gunpo, Korea)에 도말하여 37 ℃에서 24시간 배양 후 청록색 또는 보라색을 나타내는 집락을 Tryptic soy agar (TSA, BD Difco, Sparks, MD, USA) 영양배지에 옮기고 37℃에서 18~24시간 배양하여 순수 분리하였다. 생화학적 동정을 위해 배양한 균을 2~3개의 집락을 면봉으로 취하여 0.45% NaCl 용액 3 mL을 현탁하여 0.6 McFarland로 희석한 후 그람음성균을 자동으로 동정할 수 있는 GN card (BioMerieux, Durham, NC, USA)를 이용하여 Vitek 2 Compact 장비로 최종 확인하였다.
항생제 감수성 시험
TSA에서 순수분리한 균을 2~3개의 집락을 면봉으로 취하여 0.85% NaCl 용액 2 mL에 현탁 시킨다. 미생물 검사를 표준화하기 위해 세균의 수가 주어진 범위 내에 있도록 세균 현탁액의 탁도를 조절하는 표준으로 사용되는 McFarland가 0.5가 되도록 탁도를 맞추었다. Cation Adjusted Mueller-Hinton Broth (Thermo Scientific, Cheshire, United Kingdom) 11 mL에 균액 10 μL를 첨가한 후 vortexing하였다. 카바페넴 계열 항생제 4종(ertapenem, imipenem, doripenem, meropenem)이 동결건조 된 SensititreTM KORN MIC plate (Thermo Scientific, West Sussex, United Kingdom)에 균액이 첨가된 CA-MHB 용액을 50 μL씩 접종한 뒤 sealing tape를 붙여 37℃에서 16~20시간 배양하였다. 각 well에서 균이 자라지 않는 최소 농도를 Minimal Inhibitory Concentration (MIC) 측정법으로 확인하여 진단검사의학 분야의 국제 표준을 제시하는 국제적 기구인 Clinical and Laboratory Standards Institute (CLSI)의 기준에 따라 판독하였다. 표준균주는 Enterococcus faecalis ATCC 29212를 사용하였다.
항생제 내성 유전자 확인
순수분리한 균을 멸균 증류수 100 μL가 들어있는 1.5 mL microcentrifuge tube에 부유시켜 100℃에서 15분간 가열하고 4℃에서 13,000 rpm, 5분간 원심분리한 후 상층액을 template DNA로 사용하였다. SB-Plex™ CRE Detection Kit (SNB, Gwangmyeong, Korea)를 사용하여 제조사에서 제시한 방법으로 PCR을 실시하여 카바페넴 분해효소 10종(KPC, NDM, OXA, IMP, VIM, GES, SPM, SIM, GIM, SEM) 유전자를 확인하였다. 증폭산물은 자동 전기영동 장치(QIAxcel, QIAGEN, Hilden, Germany)로 전기영동하여 특이 밴드를 확인하였다. 증폭산물 확인 후 카바페넴 분해효소의 유전자 유형 확인을 위하여 MaximeTM PCR PreMix (Intron, Seongnam, Korea)를 사용하여 Primer (Bioneer, Daejeon, Korea) 2 μL, Template DNA 2 μL를 첨가해 PCR을 수행한 후 염기서열 분석을 의뢰하였다(GenoTech Co., Daejeon, Korea). 실험에 사용한 Primer는 Table 1과 같다 (14).
Table 1.
Primers used for carbapenemase gene PCR
| Target genes | Primer name | Sequence (5' to 3') | Size (bp) |
|---|---|---|---|
|
IMP [imipenemase] |
Forward Reverse |
TGA GCA ATG TAT CTG TAT TC TTA GTT GCT TGG TTT TGA TG | 740 |
|
OXA-48 [oxacillinase) |
Forward Reverse |
TTG GTG GCA TCG ATT ATC GG GAG CAC TTC TTT TGT GAT GGC | 743 |
|
VIM [Verona integrin-encoded metallo-β-lactamase] |
Forward Reverse |
TGG TCT ACA TGA CCG CGT CT CGA CTG AGC GAT TTG TGT G | 766 |
|
NDM [New Delhi metallo-β-lactamase] |
Forward Reverse |
CAA TAT TAT GCA CCC GGT CG ATC ATG CTG GCC TTG GGG AA | 720 |
|
KPC [Klebsiella pneumonia carbapenemase] |
Forward Reverse |
ATG TCA CTG TAT CGC GGT CT TTT TCA GAG CCT TAC TGC CC | 893 |
|
GES [Guiana extended-spectrum β-lactamase] |
Forward Reverse |
GCG CTT CAT TCA CGC ACT AT GCG TAA TCT CTC TCC TGG GC | 753 |
|
SME [Serratia spp.] |
Forward Reverse |
AAC GGC TTC ATT TTT G GCT TCC GCA ATA GTT TTA TCA | 830 |
|
GIM [German Imipenemase] |
Forward Reverse |
TCG ACA CAC CTT GGT CTG AA AAC TTC CAA CTT TGC CAT GC | 477 |
|
SIM [Seoul Imipenemase] |
Forward Reverse |
TAC AAG GGA TTC GGC ATC G TAA TGG CCT GTT CCC ATG TG | 570 |
|
SPM [Sao Paulo metallo-β-lactamase] |
Forward Reverse |
AAA ATC TGG GTA CTC AAA CG ACA TTA TCC GCT GGA ACA GG | 271 |
| 16S rRNA |
Forward Reverse |
AGA GTT TGA TCM* TGG CTC AG TAC GGY** TAC CTT GTT ACG ACT T | 1465 |
RESULTS
의료기관별 분포
92개 의료기관에서 의뢰된 2,429주를 검사하였고 의료기관 종별로 보면, 상급종합병원 3개 원에서 518주(21.3%), 종합병원 23개 원에서 1,168주(48.1%), 병원 20개 원에서 313주(12.9%), 요양병원 42개 원에서 424주(17.5%), 그 외 4개 의원에서 6주(0.2%)가 분리되었다 (Table 2). 상급종합병원 및 종합병원에서 신고 수가 많고, 의료기관 간 중증 환자 전원이 집중되는 것 등이 영향을 미쳤을 것으로 추정된다 (15). CRE의 주요 감염 요인이 장기간 입원환자, 만성질환자, 면역저하자 등으로 알려져 있기 때문에 (16) 상급종합병원 및 종합병원과 요양병원의 입퇴원을 반복하면서 감염요인에 노출이 많았다고 사료된다.
Table 2.
Distribution of carbapenem-resistant Enterobacteriaceae (CRE) by Medical institution type
검체별 분포
검체 종류별 분리 건수를 살펴보면 직장도말 1,295주(53.3%)으로 가장 많았으며 객담 356주(14.7%), 대변 222주(9.1%), 소변 211주(8.7%), 혈액 93주(3.8%), 상처 58주(2.4%), 담즙 45주(1.9%), 경기관흡인(transtracheal aspiration) 30주(1.2%), 고름(Pus) 28주(1.2%) 및 기타 91주(3.7%)으로 다양하였다 (Table 3).
Table 3.
Distribution of specimen by carbapenem-resistant Enterobacteriaceae (CRE) isolates
균종별 분포
연구대상 2,429주 중 2,418주가 장내세균으로 99.5%를 차지하였다. 19종 2,418주 중 K. pneumoniae가 1,698주(70.2%)로 가장 많이 분리되었고, 이는 질병관리청의 2021년 국내 CRE 감염증 신고 현황과 일치하였다. Escherichia coli (E. coli) 430주(17.8%), Enterobacter cloacae (E. cloacae) 90주(3.7%), Citrobacter freundii (C. freundii) 44주(1.8%), Enterobacter aerogenes (E. aerogenes) 34주(1.4%), Serratia marcescens (S. marcescens) 29주(1.2%) 순 이였다 (Table 4). 2021년 국내 분리 카바페넴계 항생제 내성 장내세균속종의 균종별 분포를 보면 K. pneumoniae 68.6%, E. coli 14.3%, E. cloacae 8.4%, C. freundii 2.6%, 기타 Enterobacteriaceae 6.1%로 본 연구인 부산지역의 균주 분포 경향과 유사하였다 (8). 비 장내세균은 Acinetobacter baumannii 8주, Stenotrophomonas maltophilia 2주, Pseudomonas aeruginosa 1주로 총 3종 11주가 분리되었다.
Table 4.
Identification results of collected carbapenemase-resistant Enterobacteriaceae (CRE)
카바페넴 항생제 내성 현황
카바페넴계 항생제 감수성 검사결과는 CLSI 기준에 따라 imipenem, doripenem, meropenem은 4 ug/mL, ertapenem은 2 ug/mL 이상인 경우 내성으로 판단하였다. imipenem의 경우 자연 내성을 가지고 있는 균종(Proteus spp., Providencia spp.) 14주는 제외하고 분석하였다. 비 장내세균 11주를 제외한 2,418주에 대해 최소 억제 농도(MIC)를 분석한 결과 CRE은 2,232주(92.3%), CIE (carbapenem-intermediate Enterobacteriaceae) 101주(4.2%), CSE (carbapenem-susceptible Enterobacteriaceae) 85주(3.5%)로 확인되었다. 내성주는 ertapenem 99.5%, imipenem 72.3%, meropenem 67.9%, doripenem 48.7% 순으로 내성이 확인되었다(Table 5). 항생제 내성 유형은 네 가지 항생제에 모두 내성을 갖는 균주(imipenem-ertapenem-meropenem-doripenem)가 41.5%(1,002주)로 가장 많이 확인되었다. ertapenem 단독으로 내성을 갖는 균주가 465주(19.2%), imipenem-ertapenem-meropenem 내성 유형을 갖는 균주가 366주(15.1%), imipenem-ertapenem 내성 유형을 갖는 균주가 222주(9.2%), ertapenem-meropenem 내성 유형을 갖는 균주가 78주(3.2%), ertapenem-meropenem-doripenem 내성 유형을 갖는 균주가 54주(2.2%) 순으로 나머지 유형은 26주(1.1%)이하로 확인하였다. 이는 2017∼2020년 국내 항생제 내성 유형과 동일함을 확인할 수 있었다 (4).
Table 5.
Rate of carbapenem minimum inhibitory concentration by carbapenem-resistant Enterobacteriaceae (CRE) isolates
|
Antimicrobial agent (ug/mL) | No. of isolate (%) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| ≤0.25 | 0.5 | 1 | 2 | 4 | 8 | 16 | 32 | 〉32 | |
| Ertapenem |
1 (0) |
5 (0.2) |
6 (0.3) |
214 (9.6) |
430 (19.3) |
742 (33.2) |
394 (17.7) |
218 (9.8) |
222 (9.9) |
| Imipenem |
12 (0.5) |
145 (6.5) |
169 (7.6) |
292 (13.1) |
752 (33.7) |
529 (23.7) |
155 (6.9) |
76 (3.4) |
102 (4.6) |
| Meropenem | - |
88 (3.9) |
186 (8.3) |
442 (19.8) |
642 (28.8) |
405 (18.1) |
227 (10.2) |
99 (4.4) |
143 (6.4) |
| Doripenem | - |
148 (6.6) |
337 (15.1) |
661 (29.6) |
483 (21.6) |
245 (11.0) |
146 (6.5) |
77 (3.4) |
135 (6.0) |
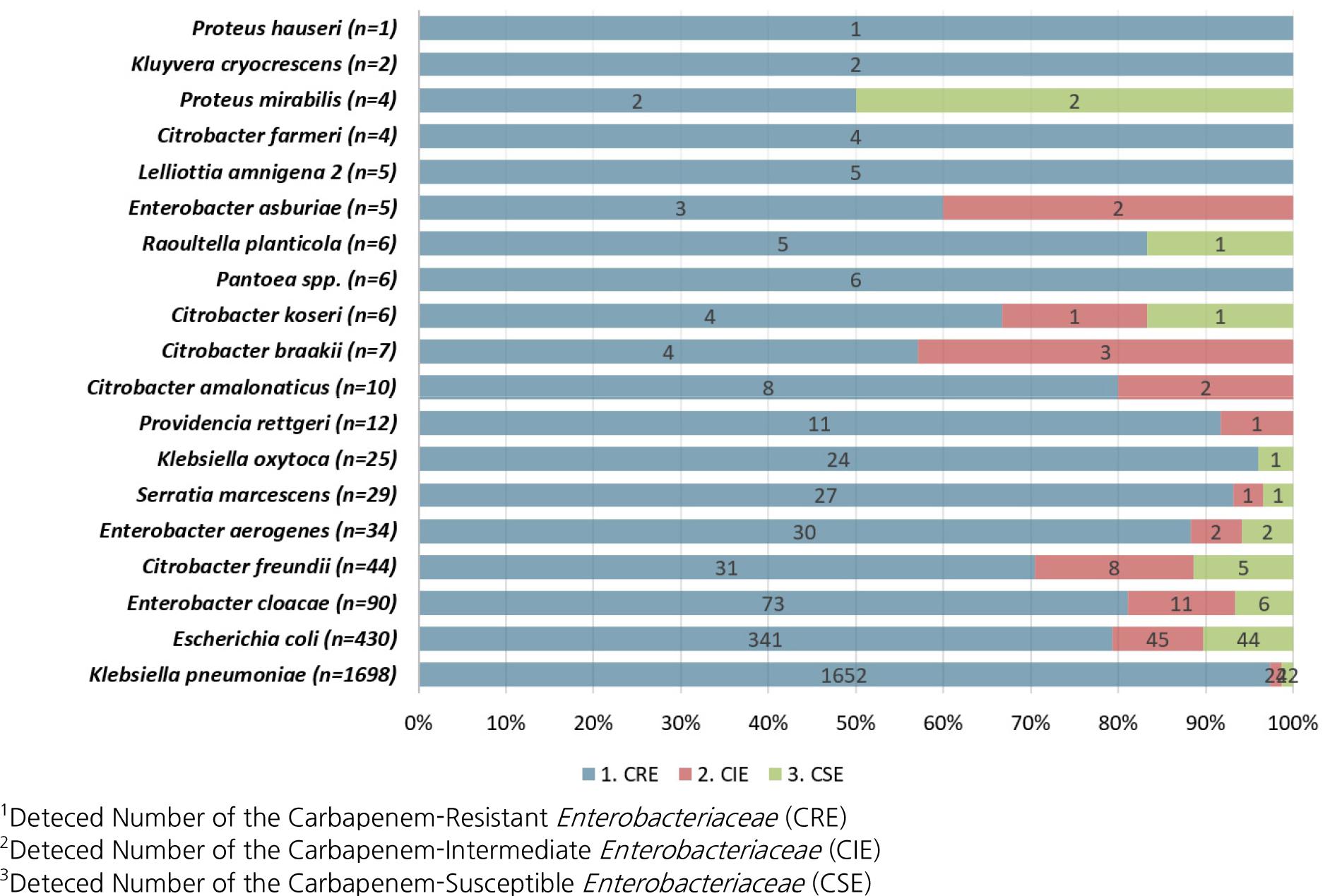
균종별로는 장내세균으로 분리된 2,418주 중 K. pneumoniae가 1,652주(68.3%)로 내성균이 가장 많았고, 이는 2017~2020년 질병관리청의 감시 결과와 일치하였다 (4). 그 다음으로 E. coli 341주(14.1%), E. cloacae 73주(3.0), C. freundii 31주(1.3%), E. aerogenes 30주(1.2%), S. marcescens 27주(1.1%), K. oxytoca 24주(1.0%), Providencia rettgeri (P. rettgeri) 11주(0.5%) 순으로 분리되었다 (Fig. 1).
CPE 유전자형별 분포
2,429주 중 CPE 검출이 2,029주였고 카바페넴 분해효소 유전자 중 KPC가 1,749주(72.0%)로 가장 많이 확인 되었고, NDM이 219주(9.0%), OXA 18주(0.7%), IMP 4주(0.2%)로 확인되었다. 카바페넴 분해효소를 2개 이상 가지는 유형이 39주(1.6%)였고, CPE 음성(non-CPE)이 389주(16.0%)였다. VIM, SME, GIM, SPM 유전자는 확인되지 않았다. 균종별 분포도는 K. pneumoniae의 경우 KPC가 1,416주(83.3%)로 가장 우세하게 나타났고, E. coli는 KPC 221건(51.4%), NDM 83건(19.3%)로 나타났다. E. cloacae는 CPE 음성이 51건(56.7%)이지만 KPC 18건(20%), NDM 16건(17.8%)으로 확인되었다. 기타 장내세균속균종에서는 KPC 94건(47%), NDM 50건(25%)로 E. coli와 유사한 분포를 보였다 (Fig. 2).
카바페넴분해효소 생성 장내세균속균종 CPE는 2,029건으로 전체 건수의 83.5%를 차지하였으며, CPE 양성이면서 CRE인 CP-CRE (carbapenem-producing carbapenem-resistant Enterobacteriaceae) 균주가 1,919건, CPE 음성이면서 CRE인 non-CP-CRE (non carbapenem-producing carbapenem-resistant Enterobacteriaceae) 균주가 389건 중 313건, CPE 양성이면서 CIE인 CP-CIE (carbapenem-producing carbapenem-intermediate Enterobacteriaceae) 균주가 61건, CPE 음성이면서 CIE인 non-CP-CIE (non-carbapenem-producing carbapenem-intermediate Enterobacteriaceae) 균주가 40주, CPE 양성이면서 CSE인 CP-CSE (carbapenem-producing carbapenem-susceptible Enterobacteriaceae) 균주가 49건, CPE 음성이면서 CSE인 non-CP-CSE (non- carbapenem-producing carbapenem-susceptible Enterobacteriaceae) 균주가 11건, 비 장내세균이 11건 이였다 (Fig. 3).

Fig. 3
Analysis results of carbapenemase-producing Enterobacteriaceae or carbapenemase-resistant Enterobacteriaceae infection.
의료기관별로 보면 상급종합병원에서 CRE 481주(92.9%), CPE 432주(83.4%), CP-CRE 407주(78.6%)가 확인되었고, 종합병원에서 CRE 1,063주(91.0%), CPE 963주(82.4%), CP-CRE 908주(77.7%), 병원에서 CRE 290주(92.7%), CPE 256주(81.8%), CP-CRE 245주(78.3%), 요양병원에서 CRE 392주(92.5%), CPE 372주(87.7%), CP-CRE 353주(83.3%), 그 외 의원에서 CRE 6주(100%), CPE 6주(100%), CP-CRE 6주(100%)가 확인되었다 (Table 6).
Table 6.
Rate of CRE, CPE, CP-CRE by Medical Institution type
| Medical institution type | No. of case (%) | ||
|---|---|---|---|
| CREa | CPEb | CP-CREc | |
| Advanced general hospital (n=3) | 481 (92.9) | 432 (83.4) | 407 (78.6) |
| General hospital (n=23) | 1,063 (91.0) | 963 (82.4) | 908 (77.7) |
| Hospital (n=20) | 290 (92.7) | 256 (81.8) | 245 (78.3) |
| Long-term care hospital (n=42) | 392 (92.5) | 372 (87.7) | 353 (83.3) |
| Clinic (n=4) | 6 (100) | 6 (100) | 6 (100) |
| Total (n=92) | 2,232 (91.8) | 2,029 (83.5) | 1,919 (79.0) |
의료기관별 카바페넴 분해효소 아형별 분포는 KPC-2가 상급종합병원에서 372주(71.8%), 종합병원 785주(57.1%), 병원 216주(69%), 요양병원 301주(71%)로 가장 많이 분리되었고, 그 중 K. pneumoniae와 KPC-2 유형이 상급종합병원 298주(57.5%), 종합병원 667주(57.1%), 병원 177주(56.5%), 요양병원 227주(53.5%)로 가장 많았다. 그 다음으로는 E. coli와 KPC-2 유형이 상급종합병원에서 50주(9.7%), 종합병원 72주(6.2%), 병원 24주(7.7%), 요양병원 61주(14.4%)로 분리되었다. NDM-1이 아형별 분포로 보았을 때 두 번째로 많았고 상급종합병원에서 19주(3.7%), 종합병원 112주(9.6%), 병원 9주(2.9%), 요양병원 15주(6.1%)로 분리되었고, K. pneumoniae와 NDM-1 유형이 종합병원 56주(4.8%)로 상급종합병원 3주(0.6%)보다 많았고, 요양병원의 경우 P. rettgeri와 NDM-1의 분포가 9주(2.1%)로 가장 많았다 (Fig. 4).

Fig. 4
Distribution of genotypes of carbapenem-resistant Enterobacteriaceae (CRE) isolates by Medical institution type. Klebsiella pneumonia carbapenemase (KPC), New Delhi metallo-β-lactamase (NDM), Oxacillinase (OXA), Imipenemase (IMP), Two or more Carbapenem-Producing Enterobacteriaceae (MIX), Non Carbapenem-Producing Enterobacteriaceae (non-CPE).
전체 2,429주 중 카바페넴 분해효소 아형별 분포는 KPC-2가 1,680주로 전체 균주의 69.2%로 가장 많이 분리되었고 NDM-1 166주(6.8%), KPC-3 58주(2.4%), NDM-5 51주(2.1%) 순 이였다. 많이 분리된 균주 및 CPE 유전형은 K. pneumoniae와 KPC-2 1,373주(56.5%)로 국내 CRE 감염증 내성 경향과 동일함을 확인할 수 있었다 (17). E. coli와 KPC-2가 207주(8.5%), K. pneumoniae와 NDM-1이 70주(2.9%) 순 이였다 (Table 7).
Table 7.
Distribution of genotypes of CRE isolates
DISCUSSION
부산지역 의료기관에서의 CRE 감염증 신고건수가 해가 갈수록 증가하고 있는 추세이다. 2021년 2,758건이였던 검사 건수가 2022년 3,057건으로 약 10% 정도 증가하였다. CRE 등 항생제 내성균이 지속적으로 증가하는 주요 원인으로는 항생제의 부적절한 처방이나 오남용이 지적되고 있고 실제 2020년 Organization for Economic Cooperation and Development (OECD) 회원국 중 4번째로 매우 높은 수준으로 보고되고 있다 (18).
CPE 분리 건수는 2021년보다 증가하였고 이 중 2021년의 경우 VIM이 5건 검출되었으나 2022년에는 검출되지 않았고, GES의 경우 2022년에만 2건 검출되었다.
2,232주의 CRE 중 CP-CRE 1,919주을 제외한 나머지 313주 CRE의 경우 카바페넴 분해효소에 의한 내성이 아닌 다른 내성 기전이 작용하였을 것이라 생각된다. non-CP-CRE의 대표적인 항생제 내성 기전은 세균의 외막 단백질의 변화 및 AmpC나 extended-spectrum β-lactamases 같은 항생제 분해효소의 과다 생성, 유출 펌프의 생성 등이 있다 (19, 20). 반면에 CP-CRE의 대표적인 내성 기전은 카바페넴 분해효소를 생성하는 것이다. 카바페넴 분해효소 생성 유전자는 보통 플라스미드를 통해 이동하여 세균들 사이에서 플라스미드를 통한 내성 유전자 전파 원인으로 작용하고 (21), 이를 통해 의료기관 내 집단유행을 일으킬 가능성이 있다. 또한 CP-CRE와 non-CP-CRE에 의한 사망률을 비교하였을 때 CP-CRE의 사망률이 4배 더 높다는 연구결과가 있다 (22, 23).
상급종합병원과 종합병원에서 신고된 검체수가 전체 검체수의 69.4%를 차지하였고 60대 이상 고 연령층에서 장기입원하는 비율이 높게 때문에 상급종합병원·종합병원·요양병원을 중심으로 CRE 감염요인에 노출 가능성이 높기 때문으로 사료된다.
K. pneumoniae의 경우 미국, 유럽 등 전 세계적으로 CRE 감염증을 일으키는 주요 원인균 중 하나이고 부산시에서도 K. pneumoniae –KPC type이 우세하게 유행하고 있었는데 이는 세계적인 유행 양상과 동일하였다 (24, 25). KPC 유전자형의 분해효소를 생성하는 CPE는 1990년대 후반부터 분리되기 시작하였고 대략 75종의 유전형이 존재하며 이 중 KPC-2 유전형의 경우 우리나라를 포함한 미국, 이탈리아, 브라질 등 전 세계적으로 넓은 분포를 이루고 있다 (20, 26). NDM은 2009년 최초로 인도에서 발견된 후 가장 널리 퍼진 유전자형 중의 하나로 aztreonam을 제외한 모든 베타-락탐에 내성을 가지고 있다 (27).
이 연구를 통해서 2022년 부산에서 분리된 CRE의 병원체 특성을 확인하여 유행 경향을 확인할 수 있었고 부산시 CRE의 포괄적인 감시를 위한 기초자료를 제공하며, 환자로부터 분리된 CRE의 특성과 감염의 역학은 효과적인 예방 전략을 개발하는데 활용될 것으로 생각된다.